厚労省の足立政務官は23日、海外での使用実績などをもとに、新たな治験を省くことが認められた医薬品(=公知申請が可能な医薬品)について、承認前に保険適用する新たな制度案を明らかにしています。
各紙によればこの新たな制度は、医療上の必要性の高い未承認薬・適応外薬検討会議で公知申請が認められた成分について、薬事・食品衛生審議会での事前評価で公知申請が可能であると判断されれば、開発企業の申請-承認を待たず(申請の手続きは従来通りに行う)に保険での使用を可能とするというものです。
公知申請とされた医薬品の取扱いについて(下記図は資料より引用)
(第177回中央社会保険医療協議会総会・資料総4 2010年8月25日開催)
http://www.mhlw.go.jp/stf/shingi/2r9852000000jw4f-att/2r9852000000jw9k.pdf
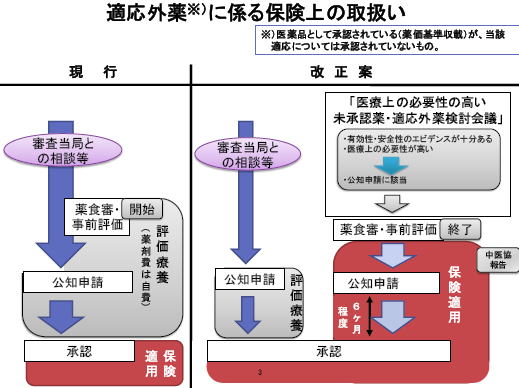
25日に開かれる中医協でこの制度案が了承されれば、 8月3日に開催された第4回医療上の必要性の高い未承認薬・適応外薬検討会議で公知申請が認められた下記5成分7適応について(下記表)、26日と30日に開催される薬事・食品衛生審議会の部会での審議を経て、今月末来月中にも保険での使用が可能となる見込みです。
| 成分名 | 商品名 | 8月3日の検討会で公知申請が可能と判断された適応 | 公知申請への該当性に係る検討会議報告書(案) |
|---|---|---|---|
| ワルファリンカリウム | ワーファリン錠 | 血栓塞栓症(静脈血栓症、心筋梗塞症、肺塞栓症、脳塞栓症、 緩徐に進行する脳血栓症等)の治療及び予防に係る小児適応血栓塞栓症の小児への適応の追加 |
PDF:828KB |
| シクロホスファミド水和物 | エンドキサン錠50mg 注射用エンドキサン100mg・同500mg |
治療抵抗性の下記リウマチ性疾患
全身性エリテマトーデス、全身性血管炎(顕微鏡的多発血管炎、ヴェゲナ肉芽腫症、結節性多発動脈炎、Churg-Strauss症候群、大動脈炎症候群等)、多発性筋炎/皮膚筋炎、強皮症、混合性結合組織病、および血管炎を伴う難治性リウマチ性疾患 |
PDF:810KB |
| カペシタビン | ゼローダ錠300 | 治癒切除不能な進行・再発の胃癌 | PDF:614KB |
| ゲムシタビン塩酸塩 | ジェムザール注射用200mg、同1g | がん化学療法後に増悪した卵巣癌 | PDF:743KB |
| トポテカン(ノギテカン塩酸塩) | ハイカムチン注射用1.1mg | がん化学療法後に増悪した卵巣癌 | PDF:776KB |
ところで、ワーファリン錠以外のワルファリン製剤(ワルファリンK細粒)は、今回の対象外なのでしょうか?
なお、他の適応で承認されていない成分については、検討会で公知申請が可能とされた場合は、下記の進め方で承認が行われるのでやはり時間がかかります。
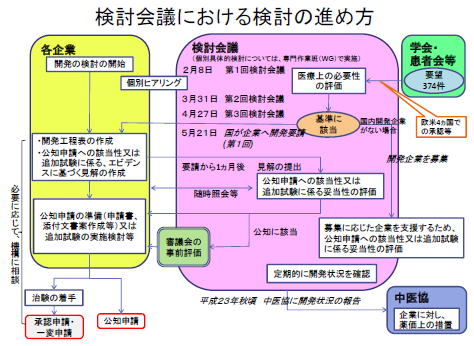
第4回 医療上の必要性の高い未承認薬・適応外薬検討会議(2010年8月3日開催)
資料:http://www.mhlw.go.jp/stf/shingi/2r9852000000inni.html
適応外薬に関する最新報告
(日本リウマチ学会 2010年8月10日)
http://www.ryumachi-jp.com/info/news100810.html
卵巣がん体験者の会スマイリーからのお知らせ
(2010年8月11日)
http://smiley.e-ryouiku.net/?day=20100811
参考:
【公知申請適応外薬】承認前に保険適用‐足立政務官がドラッグラグ解消で「新ルート」提案
(薬事日報HEADLINE NEWS 8月24日)
http://www.yakuji.co.jp/entry20300.html
厚労省、承認前の保険適用を検討 適応外薬、9カ月短縮に
(47NEWS 8月23日 共同通信配信)
http://www.47news.jp/CN/201008/CN2010082301000825.html
朝日新聞8月23日
http://www.asahi.com/national/update/0823/TKY201008230435.html
ミクスOnline 8月5日
http://www.mixonline.jp/Article/tabid/55/artid/39461/Default.aspx
薬事日報 HEADLINE NEWS 8月5日
http://www.yakuji.co.jp/entry20143.html
8月24日 11時40分 リンク追加 25日 11時00分 中医協資料を基に修正加筆
2010年08月24日 00:46 投稿

25日の中医協で、この新制度の導入が承認されたそうです。
朝日新聞8月25日
http://www.asahi.com/national/update/0825/TKY201008250220.html
薬事日報に関連記事が出ています。
【中医協】公知申請「新ルール」を了承‐30日に告示改正し新制度創設へ
(薬事日報 HEADLINE NEWS 8月26日)
http://www.yakuji.co.jp/entry20325.html
>「新ルール」によって、薬事承認前に保険適用保険適用となっても、
>薬事法上は正式に認められていないため、原則として医薬品副作用
>被害救済制度の対象にはならない。ただ、医学薬学的に妥当な使用
>とされるため、もともと除外されている抗癌剤など以外は、個別判断で
>多くが救済されると見込まれる。
この点は留意する必要がありそうです。
8月30日の官報で告示の条文を変更することで、これらの保険適応を認めています。
〇厚生労働省告示第三百三十三号
厚生労働大臣の定める評価療養及び選定療養
(平成十八年厚生労働省告示第四百九十五号)
第一条第六号の規定に基づき、保険外併用療養費に係る厚生労働大臣が定める医薬品等(平成十八年厚生労働省告示第四百九十八号)の一部を次のように改正する。
平成二十二年八月三十日
厚生労働大臣 長妻昭
第五号イ中「開始した医薬品」の下に「(当該評価が終了したものを除く。)」を加え、同号ロ中「受理された医薬品」の下に「(イの評価が終了したものを除く。)」を加え、第七号イ中「(当該期間内に医薬品一部変更承認の申請が受理されたときは、当該申請が受理された日までの期間)」を削る。
変更点は31日に厚労省がWEBで掲載しています
保険外併用療養費に係る厚生労働大臣が定める医薬品等の一部を改正する件(告示)
(厚労省 2009年8月31日)
http://www.mhlw.go.jp/bunya/iryouhoken/iryouhoken12/dl/index-126.pdf
PMDAでも、関連のページを新設しています。
保険適用される公知申請品目に関する情報について 平成22年8月分
(PMDAウェブサイト)