未承認医薬品使用問題
HOME>Keywords>未承認医薬品使用問題
1.はじめに
2004年12月15日、時の尾辻厚生労働大臣と村上規制改革担当大臣との間で「混合診療問題」について合意が交わされ、専門医の間で、効果が認知されている薬については混合診療を認めることが決まった。
★混合診療については、本サイト「混合診療とは」を参考にして欲しい。
これに基づき厚労省では、海外で承認され、国内で未承認の抗がん剤などすべての薬について、治験の対象とするべきかどうかを検討するために「未承認薬使用問題検討会議」(座長:黒川清・日本学術会議)を設置し、2005年1月24日より会合が開催されている。本ページでは、厚労省が公開する資料を基に『未承認医薬品使用問題』の概略について紹介したい。詳しく知りたい方は、厚労省等の下記のページを参考して欲しい。
| 第1回 | 2005年1月24日開催 | 資料 | 速記録 (厚労省3月22日掲載) |
| 第2回 | 2005年2月22日開催 | 資料 | 速記録 (厚労省4月20日掲載) |
| 第3回 | 2005年3月31日開催 | 資料 | 速記録 (厚労省6月3日掲載) |
| 第4回 | 2005年4月27日開催 | 資料 | 速記録 (厚労省7月4日掲載) |
| 第5回 | 2005年7月22日開催 | 資料 | 速記録 (厚労省9月15日掲載) |
| 第6回 | 2005年10月31日開催 | 資料 | 速記録 (厚労省12月1日掲載) |
| 第7回 | 2006年1月19日開催 | 資料 | 速記録 (厚労省2月21日掲載) |
| 第8回 | 2006年4月27日開催 | 資料 | 速記録 |
| 第9回 | 2006年7月28日開催 | 資料 | 速記録 (厚労省9月1日掲載) |
| 第10回 | 2006年10月27日開催 | 資料 | 速記録 (厚労省12月11日掲載) |
| 第11回 | 2007年1月22日開催 | 資料 | 速記録 (厚労省3月7日掲載) |
| 第12回 | 2007年4月26日開催 | 資料 | 速記録 (厚労省8月1日掲載) |
| 第13回 | 2007年7月30日開催 | 資料 | 速記録 |
| 第14回 | 2007年10月29日開催 | 資料 | 速記録 (厚労省12月27日掲載) |
★「未承認薬使用問題検討会議」での検討結果等について (PDF:126KB、第14回資料5)
★「未承認薬使用問題検討会議」での検討結果を受けて
国内で治験準備中又は実施中の医薬品に関する情報(厚労省HP)
2.「未承認薬使用問題検討会議」が目指すもの
「未承認薬使用問題検討会議」開催要綱によれば、この検討会議は、 欧米諸国で承認されているが、国内では未承認の医薬品(以下「未承認薬」という。)について、欧米諸国での承認状況及び学会・患者要望を定期的に把握し、 臨臨床上の必要性と使用の妥当性を科学的に検証するとともに、当該未承認薬について確実な治験実施につなげることにより、その使用機会の提供と安全確保を図ることを目的として、今後は次のような事項を検討していくという。
- 欧米諸国での承認状況の定期的な把握
- 学会及び患者の要望の定期的な把握
- 未承認薬の臨床上の必要性と使用の妥当性に関する科学的検証
- 「企業依頼」及び「医師主導」の治験への振り分けと確実な実施
- 安全性確認試験の確実な実施 等
第3回の検討会議では、ワーキンググループ(WG)の設置が決まった。このWGは、がん、小児、循環器の3領域の専門家で構成され、その他の領域(例:精神・神経、臓器移植など)については、品目に応じて、随時専門家を選定されるという。WGの専門家は、各領域における医薬品の研究開発及び治験制度に精通した者を座長が指名し、検討会議で成分ごとのWGからの検討結果が報告される。 なお、メンバーは、検討品目に関して関与又は特別の利害関係を有する場合は座長に申し出ることとし、関与等がある場合は、当該品目について発言することができないという。
●未承認薬に関わる未承認薬に係る3種類の治験の実施までの流れ(PDF:81KB、第4回資料1)
●未承認薬を治験対象とする場合の考え方 (PDF:53KB、第5回参考資料4)
●ワーキンググループの設置について(PDF:52KB、第4回資料4)
●適応外使用通知に基づく承認品目リスト (PDF:202KB、第7回資料6-2)
3.対象となる医薬品
●「未承認薬使用問題検討会議」における対象医薬品 (PDF:46KB、第5回参考資料3)
類型I:2005年4月以降に欧米4カ国で承認されたもの
2005年4月以降に、英米独仏4カ国のいずれか1カ国で新たに承認されたものについては、類型Ⅰとして検討の対象とし、年4回のペースで予定されている検討会ごとに、WGが検討結果を報告する。
★2005年4月~6月に、欧米4カ国のいずれかの国で新たに承認された医薬品
(PDF:112KB)
(第5回検討会:資料1)
★2005年7月~9月に、欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:69KB)
(第6回検討会:資料3)
★2005年10月~12月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:137KB)
(第7回検討会:資料2)
★2006年1月~3月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:97KB)
(第8回検討会:資料3)
★2006年4月~6月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:151KB)
(第9回検討会:資料3)
★2006年7月~9月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:77KB)
(第10回検討会:資料3)
★2006年10月~12月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:85KB)
(第11回検討会:資料3)
★2007年1月~3月に欧米4カ国のいずれかの国で新たに承認された医薬品 (PDF:90KB)
(第12回検討会:資料4)
★2007年4月~6月に欧米4カ国のいずれかの国で新たに承認された医薬品(PDF:120KB)
(第13回検討会:資料4)
★2007年7月~9月に欧米4カ国のいずれかの国で新たに承認された医薬品(PDF:101KB)
(第14回検討会:資料4)
類型II:過去5年間に学会・患者団体からの要望があり、かつ平成17年3月以前に欧米4か国で承認されたもの
(1) 国内治験前の未承認薬
(2) 国内治験中~申請準備中の未承認薬
(3) 国内承認審査中の未承認薬
(4) 未承認薬として検討されていた成分で、承認されたもの
(5) 2005年4月に患者団体から追加で未承認薬使用問題検討会議での検討の要望があった医薬品
(PDF:129KB)(第5回検討会資料2-1)
(6) 2005年4月以降に学会・患者団体から追加で早期承認の要望のあった医薬品
(PDF:82KB)(第5回検討会資料2-1)
(PDF:47KB)(第6回検討会資料4)
(PDF:44KB)(第7回検討会資料3)
(PDF:51KB)(第8回検討会資料1)
(PDF:48KB)(第9回検討会資料1)
(PDF:48KB)(第10回検討会資料1)
(PDF:51KB)(第11回検討会資料1)
(PDF:43KB)(第12回検討会資料3-1)
(PDF:50KB)(第13回検討会資料3-1)
類型III:学会・患者団体からの要望はないが、過去2年間に欧米4か国で承認され、かつ医療上の有用性が高いと考えられるもの
今後年4回のペースで予定されている検討会に、WGが検討結果を報告する。
●(2003年1月~2005年3月)に欧米4ヶ国のいずれかの国で新たに承認された医薬品
(PDF:17KB)(第6回検討会資料)
★過去2年間に米国で承認された新有効成分含有医薬品(PDF:17KB)(第3回検討会資料)
★未承認薬使用問題検討会議での検討結果を受けて
国内で治験準備中又は実施中の医薬品に関する情報(厚労省HP)
参考:承認薬の早期承認に関する要望書等
2007年1月~3月分(PDF:80KB、第12回検討会資料3-2)
2007年4月~6月分(PDF:66KB、第13回検討会資料3-2)
2007年5月~9月分(PDF:71KB、第13回検討会資料3)
4.欧米諸国での承認状況の定期的な把握の方法
切実な患者要望に的確に対応するため、(財)日本医薬情報センターに委託し、米、英、独、仏、及び承認審査に係る薬事規制が日本と同等と考えられる国で承認されたものについて、下記についての調査を行う。
- 承認された国名
- 承認年月日
- 成分名(一般的名称)
- 銘柄名
- 会社名及び国内法人の有無
- 剤型・規格
- 効能・効果
- 用法・用量
- 承認された国における添付文書の記載内容(作用機序、副作用等)
これらの情報は、FDAのウェブサイト、EMEAのウェブサイト、外電情報、Scrip及びFD&C Report等により、新薬承認情報等を通じて入手・調査し、3ヵ月の調査期間の翌月までに結果をとりまとめる。
●未承認薬の欧米における承認状況の把握について(PDF:89KB、第4回資料3)
5.未承認薬を治験対象とする場合の考え方
医療上特に必要性が高いと認められるもので、適応疾病の重篤性と医療上の有用性とを総合的に評価して選定する。具体的には、
(1)適応疾病の重篤性
・生命に重大な影響がある疾患(致死的な疾患)
・病気の進行が不可逆的で、日常生活に著しい影響を及ぼす疾患 等
(2)医療上の有用性
・既存の治療法・予防法がない
・欧米の臨床試験において有効性・安全性等が既存の治療法・予防法と
比べて明らかに優れている
・欧米において標準的治療法に位置付けられている 等
●未承認薬を治験対象とする場合の考え方 (PDF:53KB、第5回参考資料4)
6.未承認薬に係る治験の種類
検討会ではさらに、確実な治験の実施に繋げ、制度的に切れ目なく保険診療との併用(特定療養費化)が可能な体制を確立するために、未承認薬に係る3種類の治験についての位置づけも示している。
| 位置づけ | 実施の対象 となる薬剤 |
参加対象患者 の範囲 |
|
|---|---|---|---|
| 承認申請のための治験 | 学会・患者団体から使用の要望が出されている未承認薬について、 薬事法上の承認申請を主目的として、企業依頼又は医師主導によって実施される治験。 企業に対し実施の可否の検討を依頼するものとするが、実施が困難な場合、医師主導治験による対応も検討する |
未承認薬のうち、国内において治験が未だ開始されていないものであって、未承認薬使用問題検討会議によって試験実施の了承が得られたもの。 | 未承認薬の使用を希望する患者のうち、「承認申請のための治験」の患者選定基準に適合する患者。 |
| 追加的治験 | 「承認申請のための治験」が既に開始され、又は開始に向けた準備を終えた未承認薬について、 未承認薬の有効性・安全性を追加的に確認すること及び希望する患者に使用機会を提供することを目的とした試験として、「承認申請のための治験」とは別に実施される治験。 企業に対し実施の可否の検討を依頼するものとするが、実施が困難な場合、医師主導治験による対応も検討する。 |
「承認申請のための治験」が既に開始又は開始に向けた準備を 終えた未承認薬のうち、未承認薬使用問題検討会議によって試験実施の了承が得られたもの。 | 未承認薬の使用を希望する患者のうち、 「承認申請のための治験」の患者選定基準に適合する患者、又は主治医等による適切な医学的判断・管理がされている患者。 |
| 安全性確認試験 | 学会・患者団体から使用の要望が出されている未承認薬のうち、「承認申請のための治験」が終了したもの、又は承認申請中のものについて、・ あらかじめ、承認後の使用実態を想定して、臨床使用成績を把握することにより、承認時に一層の適正使用を図るために、治験終了後承認申請前又は承認申請中に実施される治験。 承認後の使用実態を想定し て実施する試験であるため、企業依頼治験とする。 |
「承認申請のための治験」が終了、又は承認申請中の未承認薬のうち、未承認薬使用問題検討会議によって試験実施の了承が得られたもの。 | 承認取得後に、主治医等による適切な医学的判断・管理の下、 未承認薬が使用されることが想定される患者と同等の患者。 |
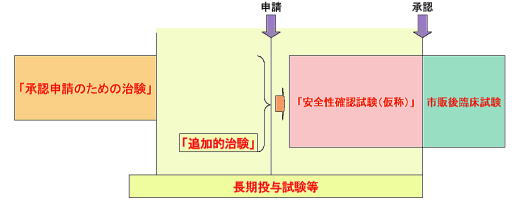
未承認薬使用問題検討会議第3回資料:
資料8「追加的治験」と「安全性確認試験(仮称)」(案)より引用
「追加的治験」について
- 未承認薬の使用の要望は、通常「承認申請のための治験」の中で実施される「長期投与した場合の安全性評価のための試験(長期投与試験)」等によってできるだけカバーする
- 「追加的治験」は、長期投与試験等によってもカバーできない ケースに対して限定的に実施されるもの。
- 「追加的治験」の対象患者の範囲は、安全性の観点から厳重な 管理が必要な抗がん剤等においては、「承認申請のための治験」 とほぼ同じと考えられる。
「安全性確認試験(仮称)」について
- 「安全性確認試験(仮称)」は、承認後の使用実態を想定して臨床使用成績を把握することにより、承認時に一層の適正使用を 図るために実施される試験。
- これまで市販後臨床試験が求められたようなケースにおいて、それを承認前から前倒しで実施するもの。
- 海外でも同様の試験がフェーズⅢbとして求められつつあり、国際調和の観点からも必要なもの。
文献:1.第3回未承認薬使用問題検討会議 資料
http://www.mhlw.go.jp/shingi/2005/03/s0331-13.html
2.薬事日報2005年2月25日
http://www.yakuji.co.jp/contents/yakujinippo/y200502250101.html
最終更新日 2008年1月6日
(文責:小嶋慎二)